一、工业上如何制取镁单质?
工业上利用电解熔融氯化镁或在电炉中用硅铁等使其还原而制得金属镁
MgCl2(l)==熔融电解==
Mg(s)+Cl2(g)↑
二、工业知取镁的方法
从海水中提取镁的步骤是先将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳,将石灰乳加入到海水沉淀池中,得到氢氧化镁沉淀,将氢氧化镁与盐酸反应,蒸发结晶可获得六水合氯化镁(MgCl2·6H2O)
1)CaCO3(贝壳的主要成分)==高温煅烧==CaO+CO2
2)CaO+H2O====Ca(OH)2
3)MgCl2(海水中的混合物)+Ca(OH)2====Mg(OH)2↓+CaCl2
4)Mg(OH)2+2HCl====MgCl2+2H2O
将六水合氯化镁晶体在一定条件下加热生成无水氯化镁,电解熔融的氯化镁可以得到金属镁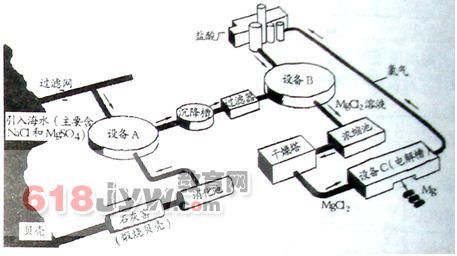
5)MgCl2==通电==Mg+Cl2↑
三、工业上制取镁的流程.
mg2+
+cao+h2o===mg(oh)2↓+ca2+
mg(oh)2+2hcl====mgcl2+2h2o
mgcl2(aq)==蒸发==mgcl2·6h2o
mgcl2·6h2o====hcl=加热===mgcl2+6h2o
mgcl2(熔融)====通电====mg+cl2↑要在干燥的氯化氢气体中脱水,因为氯化镁会水解,加入氯化氢可以抑制它向水解的方向发生化学移动
1.
提供原料碳酸钙
caco3=cao+co2
co2+h2o=ca(oh)2
2.mgcl2+ca(oh)2=mg(oh)2+cacl2
mg(oh)2
+2hcl=mgcl2+2h2o
mgcl2=mg+cl2(条件是电解)
3.一是采用海滩上的贝壳制做原料。二是采取了富集氯化镁的方案,(也就是把海水中的氯化镁成为氢氧化镁沉淀,然后再与盐酸反应生成氯化镁)
四、工业如何制取金属镁
你好,由于海水里面有大量的氯化镁(MgCl2),所以说一般通过电解氯化镁的方法制取镁单质。
第一步,将海水倒入沉淀槽中,加入过量的氢氧化钙与氯化镁发生化学反应,生成氢氧化镁沉淀和氯化钙。(MgCl2+Ca(OH)2=Mg(OH)2+CaCl2),这一步的目的是为了得到较纯净的氢氧化镁。
第二步,将溶液蒸发,再加入过量的盐酸溶液,得到氯化镁和水
(Mg(OH)2+2HCl=MgCl2+2H2O)
第三步,使溶液蒸发,将氯化镁在熔融状态下电解,得到氯气与金属镁。(MgCl2=(等号上是电解,下是熔融)Mg+Cl2)同时,让氯气与氢气再点燃就可以生成氯化氢气体,通入水就可以实现重复利用。
这样做可能会产生氯化钙杂质。
五、工业冶炼镁的两个方法,要两种方法的方程式
①制取无水氯化镁:
常用方法:2MgO+C+2Cl2=2MgCl2+CO2
【高中化学常用方法:6水氯化镁晶体在HCl气体氛围中加热脱水】
②电解熔融的氯化镁,常加入助溶剂CaCl2,可以降低熔点,增加导电性。
MgCl2 =电解=Mg+Cl2↑
扩展资料
氯化镁纯品为无色单斜结晶,工业品通常呈黄褐色,有苦咸味。容易吸湿,溶于水100℃时失去2分子结晶水。常温下其水溶液呈中性。
在110℃开始失去部分氯化氢而分解,强热转为氧氯化物,当急速加热时约118℃分解。其水溶液呈酸性熔点118℃(分解,六水),712℃(无水)。
沸点:1412℃(无水)水合的氯化镁加热时失水和氯化氢部分生成氯化氢和碱式氯化镁。
六、工业提取单质镁的方程式
工业方法常用电解氯化镁的方法。步骤如下:
①制取无水氯化镁:
常用方法:2MgO+C+2Cl2=2MgCl2+CO2
【高中化学常用方法:6水氯化镁晶体在HCl气体氛围中加热脱水】
②电解熔融的氯化镁,常加入助溶剂CaCl2,可以降低熔点,增加导电性。
MgCl2
=电解=Mg+Cl2↑
希望对你有帮助O(∩_∩)O~