一、什么是sp,sp2,sp2杂化?怎样判别?
高中化学一般有提及,sp杂化
同一原子内由一个ns轨道和一个np轨道发生的杂化,称为sp杂化.杂化后组成的轨道称为sp杂化轨道.sp杂化可以而且只能得到两个sp杂化轨道.
实验测知,气态BeCl2是一个直线型的共价分子.Be原子位于两个Cl原子的中间,键角180°,两个Be-Cl键的键长和键能都相等:
Cl-Be-Cl(sp1杂化)
基态Be原子的价层电子构型为2s2,表面看来似乎是不能形成共价键的.但杂化理论认为,成键时Be原子中的一个2s电子可以被激发到2p空轨道上去,使基态Be原子转变为激发态Be原子(2s12p1):
与此同时,Be原子的2s轨道和一个刚跃进的电子的2p轨道发生sp杂化,形成两个能量等同的sp杂化轨道:
其中每一个sp杂化轨道都含有 轨道和 轨道的成分.每个sp轨道的形状都是一头大,一头小.成键时,都是以杂化轨道大的一头与Cl原子的成键轨道重叠而形成两个σ键.根据理论推算,这两个sp杂化轨道正好互成180°,亦即在同一直线上.这样,推断的结果与实验相符.(此处注意,BeCl2的分子构型不止sp杂化一种,还可以以sp2杂化而形成二聚体,也可以以sp3杂化形成多聚体,其分子构型不一定为直线型.)
此外,周期表ⅡB族Zn,Cd,Hg元素的某些共价化合物,其中心原子也多采取sp杂化.
注意两点:
(1)原子轨道的杂化只有在形成分子的过程中才会发生;
(2)能量相近通常是指:ns与np、ns,np与nd或(n-1)d.在形成分子时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新的轨道,这种轨道重新组合的过程叫做杂化.
sp杂化例子、CO2 (sp1杂化) 、 C2H2(sp1杂化)CH4(sp3杂化)
二、常见SP,SP2,SP3杂化例子
1、sp杂化:例如BeCl₂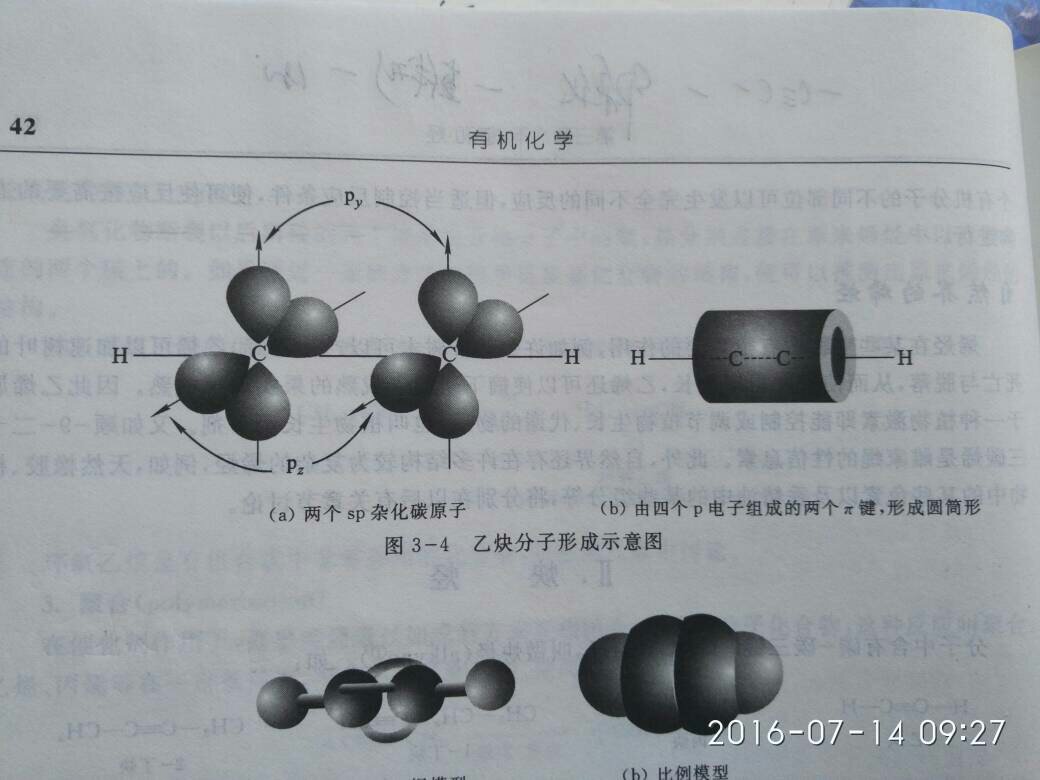
BeCl₂:基态Be的外层电子构型为2s²,在成键时先发生激发,成为激发态2s² 。随即发生杂化,即 Be的1个2s 轨道和1个2p 轨道进行sp杂化,形成两个sp杂化轨道,每个杂化轨道中各有一个未成对电子。所形成的BeCl₂的几何构型为直线形。
2、sp²杂化:例如乙烯。
乙烯是最普遍的sp²杂化形式,碳原子在形成乙烯分子时,每个碳原子的2s轨道与两个2p轨道发生杂化,称为sp²杂化,其形状与sp³杂化轨道相似,在空间以碳原子为中心指向平面三角形的三个顶点。未杂化的一个2p轨道则垂直与杂化轨道的平面。
3、sp³杂化:例如CH₄。
CH₄:基态C原子只有两个未成对电子 ,在形成 时 ,在H的影响下,C的1个2s轨道和3个 2p轨道进行sp³杂化,形成4个sp³杂化轨道,每个sp³杂化轨道中各有一个未成对电子。C用4个sp3杂化轨道分 别与4个H的1s轨道重叠形成4个σ键。生成的CH₄的几何构型为正四面体。
扩展资料
1、杂化的发生条件
(1)原子轨道的杂化只有在形成分子的过程中才会发生;
(2)能量相近的原子轨道间才能发生杂化,能量相近通常是指:ns与np、ns,np与nd或(n-1)d。
2、苯环中的每个碳原子采用sp²杂化方式,每个碳原子都有一未参加杂化的p轨道。由于苯是平面分子,因此6个未参加杂化的p轨道互相平行。所以苯分子中有大π键。
3、实验测知BF₃的4个原子在同一平面上,键角∠FBF等于120°。B原子成键时1个2s电子激发到1个空的2p轨道上,与此同时,1个s轨道和2个p轨道“混合”起来成为3个杂化轨道,分别与3个F原子成键。
参考资料来源:百度百科-sp杂化
参考资料来源:百度百科-sp²杂化
参考资料来源:百度百科-sp³杂化